Thèse présentée à la Faculté
des sciences de l'Université de Paris
pour obtenir le grade de
Docteur es Sciences Physiques
par ¶
Pierre Cresson
Application de la
transposition de Claisen à la synthèse d'aldéhydes g-d-éthyléniques
soutenue le 25 mai 1964
devant la commission d'examen
:
Prévost, C., président
Normant, Cadiot, examinateurs
INTRODUCTION
A côté des
transformations purement nucléophiles ou,électrophiles, généralement catalysées
par des bases ou des acides, diverses réactions peuvent se produire, dans lesquelles l'un
des réactifs attire les électrons tandis que l'autre les repousse. Ce transfert
électronipue concerté est particulièrement favorisé lorsqu'il s'opère en circuit fermé, selon un
schéma hexagonal.
Le mécanisme
intéresse des réactions classiques telles que le réarrangement des éthers
allyliques de phénols, la synthèse de cétones g-éthyléniques ou de diénones conjuguées, les
additions 1-4 des systèmes conjugués, les synthèses diéniques, les pyrolyses
d'esters ou de xanIhogénates, pour ne citer que les plus importantes. Une< revue générale
de ces réactions a été faite récemment par VON DOERING.
Ce transfert
électronique est facilité en série hétéro-atomique, en particulier dans le cas
des éthers vinyl-allyliques; il constitue l'extension du réarrangement de CLAISEN et se
schématise ainsi
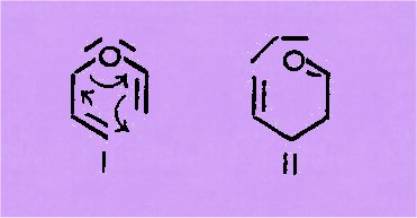
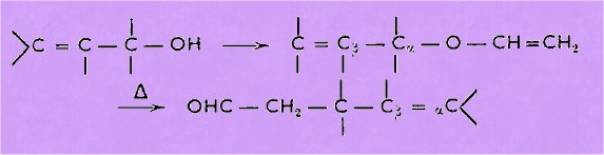
Les éthers 1
conduisent aux carbonylés g-d-éthyléniques II. Les modes d'obtention
de ces éthers sont variés et nous nous sommes adressés en particulier à une réaction étudiée par K.
C. BRANNOCK en 1959.
L'action d'un
aldéhyde a-ramifié sur l'alcool allylique conduit, en
milieu acide, à l'acétal qui se décompose partiellement en éther d'énol, lequel se
réarrange en penténal disubstitué.
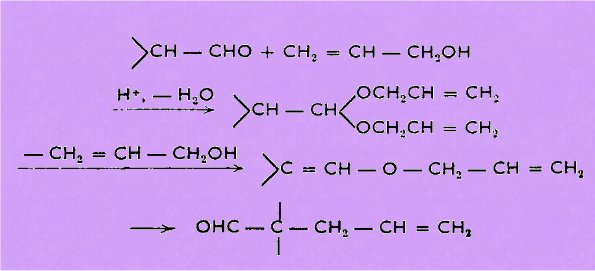
Nous avons
cherché à généraliser la réaction en l'appliquant à des alcools a-éthyléniques variés, autres que primaires. Nous avons également
étudié avec ces carbinols, la réaction de transvinylation découverte par WATANABE et CONLON en
1957 :
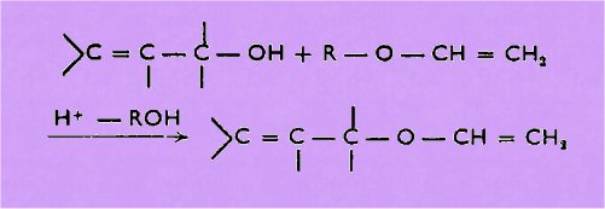
Enfin nous
proposons, pour ces éthers vinyliques, une synthèse plus générale que les
précédentes.
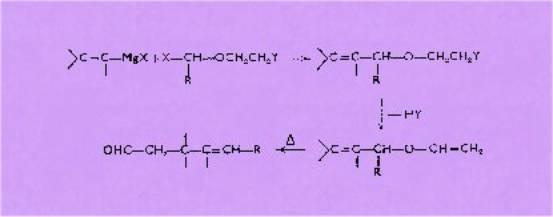
L'action d'un
magnésien vinylique et du dérivé chloro-méthylé d'une halohydrine conduit à des
éthers allyliques< halogènes, suivant :
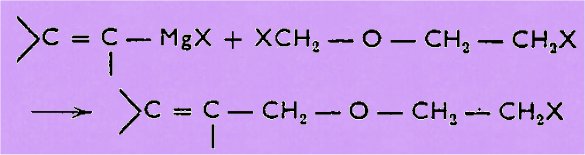
L'action d'une
base convenable permet ensuite le passage à l'éther d'énol
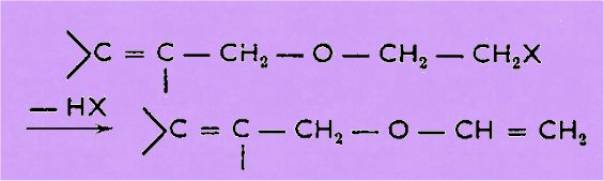
Tous ces éthers, chauffés, conduisent
aux aldéhydes g-éthyléniques suivant le même schéma :
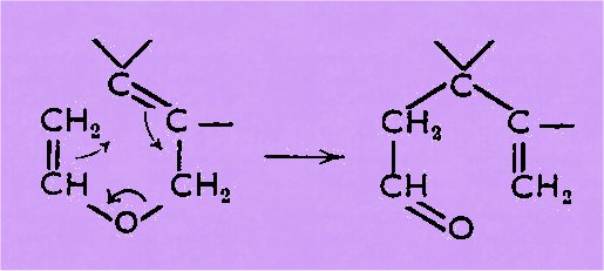
Notre travail
comprend deux parties :
PARTIE 1
Généralisation de la réaction de
Brannock.
CHAPITRE I. —
Préparation des alcools a-éthyléniques.
CHAPITRE II. — Application de la
réaction aux alcools préparés. Essais d'acétalisation. Méthode adoptée.
CHAPITRE III. — Mécanismes
et résultats.
CHAPITRE IV. —
Application de la réaction de trans-vinylation aux alcools cités.
CHAPITRE V. —
Partie expérimentale.
PARTIE II
Méthode originale de préparation des carbonylés -
g-éthyléniques.
CHAPITRE I. — Partie théorique.
I. — Réactions des magnésiens vinyliques et des dérivés
chlorométhylés des halohydrines.
II. — Passage aux éthers vinyl-allyliques.
III. —
Réarrangement des éthers. Étude spectrale des produits.
CHAPITRE II. —
Partie expérimentale.
CONCLUSION
La transposition, selon GLAISEN, des éthers
vinyl allyliques constitue une préparation commode des aldéhydes g-d-éthyléniques. Le mécanisme cyclique permet de préciser la
structure du carbonylé obtenu.
K. C. BRANNOCK
a appliqué cette réaction au départ d'aldéhydes ramifiés et
d'alcool allylique.
Dans la
première partie de notre travail, nous avons généralisé cette méthode en
l'étendant à des alcools a-éthyléniques très divers, de toutes
classes, facilement accessibles au laboratoire.
Nous avons
montré en particulier que le couple d'alcools métamères primaire-tertiaire,
constitué par les méthyl-buténols, conduisait à des produits différents avec
l'iso-buténol, de même qu'avec l'aldéhyde hydratropique. Par contre, le
phényl-vinyl-carbinol et l'alcool cinnamiquc donnent un produit unique.
Nous en avons
proposé une explication. Le mécanisme pourrait s'appliquer aux réactions des
alcools secondaires aliphatiques qui nous ont donné des aldéhydes éthyléniques
de structure trans, et à celles des vinyl-hydroxy-cycloalcanes qui ont conduit
aux aldéhydes du type :
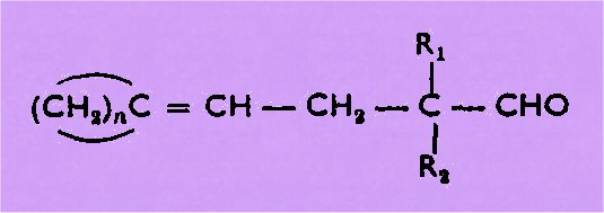
La réaction de
BRANNOCK, au départ d'aldéhyde a-ramifié, ne peut conduire qu'à des
aldéhydes éthyléniques aa-disubstitués :
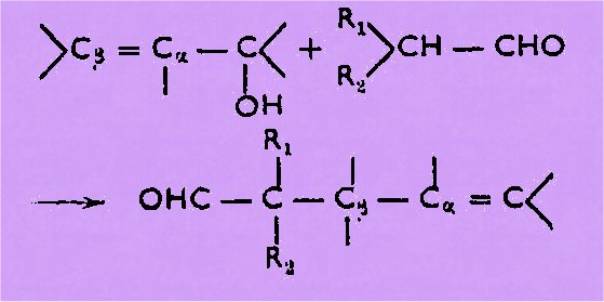
Nous avons vu
que la réaction de transvinylation donne des carbonylés non substitués mais
l'application est limitée à un certain nombre d'alcools :
La méthode nouvelle,
proposée dans la deuxième partie, conduit aussi à des aldéhydes non substitués,
mais elle a l'avantage d'être beaucoup plus générale.
En outre, elle évite le
passage par les alcools allyliques, leur transposition éventuelle et
l'obtention de mélanges, pour conduire de façon univoque aux produits attendus.
Nous avons obtenu des éthers et aldéhydes très variés, dont certains peuvent
constituer des intermédiaires de synthèse importants. Ces composés possèdent
souvent des propriétés olfactives marquées et peuvent intéresser l'industrie de
la parfumerie.
Notre méthode utilise des
produits facilement accessibles au laboratoire et paraît susceptible d'une plus
grande extension à partir des halohydrines du type : R—CHX—CH2OH qui conduiront
aux dérivés chloro-méthylés :
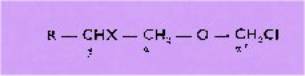
Ceux-ci peuvent
être vinylés en a' par les vinyl métaux, pour conduire
après déshydrohalogénation en a-b, aux éthers du type :
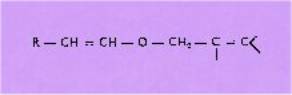
Ces derniers,
transposés selon GLAISEN, conduiront aux aldéhydes a-monosubstitués :
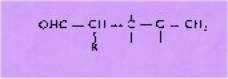
MOTS CLEFS /acétal / acide / action / alcool / aldéhyde / aliphatique /
allylique / brannock / buténol / carbinol / chlorométhylé / claisen / conlon / cyclique /
cycloalcane / diénone / doering / électrophile / énol / éther / éthylénique / glaisen /
halohydrine / magnésien / mécanisme / méthode / parfumerie / pentènal / phénol / réaction /
structure / synthèse / transposition / transvinylation / vinyl / vinylation / watanabe /
xanthogénate / cresson / prévost